الكربون: العنصر الأبرز في تكوين الروابط
التساهمية
ذكَرنا في الفصل الأول أنَّ عدد المركبات
الكربونية المحتملة كبير جدًّا لدرجة أنه من
المستحيل تحقيقه. أُطلق على هذا العدد الهائل من
البُنى مصطلح غير مألوف وهو الفضاء الكيميائي. فمن
جانب، تُوجد أوجه تشابُه بين استكشاف الكون
واستكشاف عملية تخليق مركباتٍ عضوية جديدة. ففي
كلتا الحالتَين يُعتبَر الاستكشاف عمليةً لا
نهائية، لكنها تزخَر باكتشافاتٍ مُثيرة. في هذا
الجزء من الفصل، سنستكشف السبب الذي يجعل الكربون
العنصر الأنسب، من بين جميع العناصر الأخرى، لإنتاج
الكثير من المركبات المختلفة.
العدد الذري للكربون هو ٦، ما يعني أن نواته
تحتوي على ستة بروتونات. في ذرة الكربون المتعادلة،
يوجَد ستة إلكترونات تشغل الحيِّز المُحيط بنواتها
(شكل
٢-١).
تشغل هذه الإلكترونات غلافَين (أو مدارَين)
مختلفَين حول النواة. يحتوي الغلاف الأول الداخلي
على إلكترونَين، وهو أقصى عدد من الإلكترونات يُمكن
له أن يستوعِبه، بينما يستوعب الغلاف الثاني
(الغلاف الخارجي) بقية الإلكترونات. تُسمى
إلكترونات الغلاف الخارجي بإلكترونات التكافؤ، وهي
التي تُحدِّد الخصائص الكيميائية للذرة. و«الوصول»
إلى إلكترونات التكافؤ سهلٌ مقارنةً بإلكترونَي
الغلاف الأول. فإلكترونا الغلاف الداخلي أقرب إلى
النواة، وتحجبهما إلكتروناتُ الغلاف الثاني.
ثمة أهمية كبيرة لوجود الكربون في منتصف الجدول
الدوري. تفقد العناصر الموجودة قرب الجانب الأيسر
من الجدول الدوري إلكتروناتِ تَكافئها لتكوين
أيوناتٍ موجبة. على سبيل المثال، يمكن لعنصر
الليثيوم أن يفقد إلكترونَ تَكافئه الوحيد لتكوين
أيون الليثيوم الموجب
(Li+)،
ويمكن للمغنيسيوم أن يفقد إلكترونَي تَكافئه لتكوين
أيون المغنيسيوم الموجب
(Mg2+)،
أما الألومنيوم، فيمكن أن يفقد إلكتروناتِ تكافئه
الثلاثة لتكوين أيون الألومنيوم الموجب
(Al3+).
أما العناصر الموجودة على الجانب الأيمن من الجدول
الدوري، فتكتسب إلكتروناتٍ لتكوين أيونات سالبة
الشحنة. على سبيل المثال، يمكن لعنصر الفلورين أن
يكتسب إلكترون تكافؤ واحدًا لتكوين أيون الفلوريد
(F−)،
بينما يمكن للأكسجين أن يكتسب إلكترونَي تكافؤ
لتكوين أيون الأكسيد
(O2−).
إن الدافع الذي يُحرِّك العناصر نحو تكوين أيونات
هو الوصول بالذرة إلى حالة الاستقرار التي لا تتحقق
إلا بوصول الأغلفة الخارجية إلى السعة الكاملة من
الإلكترونات. على سبيل المثال، يحتوي أيون الفلوريد
على أقصى سعة من الإلكترونات في غلافه الخارجي، وهي
ثمانية إلكترونات. وبالمثل، عندما يفقد أيون
الليثيوم إلكترونَ تكافئه الوحيد، فإن ما يتبقَّى
هو غِلاف داخلي يحتوي على أقصى سعة له من
الإلكترونات.
يمكن للعناصر في يمين الجدول الدوري ويساره أن
تكوِّن أيوناتٍ بسهولة، ولكن تزداد صعوبة الأمر
للعناصر في منتصف الجدول الدوري. فلكَي يصل الغِلاف
الخارجي لذرة الكربون إلى أقصى سعةٍ له من
الإلكترونات، عليه أن يفقد أو يكتسب أربعةً من
إلكترونات التكافؤ، ولكن قد يستلزم الأمر قدرًا
كبيرًا للغاية من الطاقة. لهذا السبب، يصل الغلاف
الخارجي في ذرة الكربون إلى حالة الاستقرار والسعة
الكاملة بطريقةٍ أخرى. تشارك الذرة إلكتروناتٍ مع
عناصر أخرى لتكوين روابط. يبرع الكربون في هذه
العملية، ويمكن اعتباره العنصر الأبرز في تكوين
روابط تساهمية. فبدلًا من أن يظلَّ منعزلًا في صورة
ذرةٍ أو أيون، تُكوِّن ذرة الكربون روابط مع ذراتٍ
أخرى لتكوين شبكاتٍ من الذرات تُسمَّى الجزيئات.
ترتبط الذرات معًا عبر روابط تساهمية، تحتوي كل
منها على إلكترونَين مشتركَين بين الذرتَين
المرتبطتَين معًا.
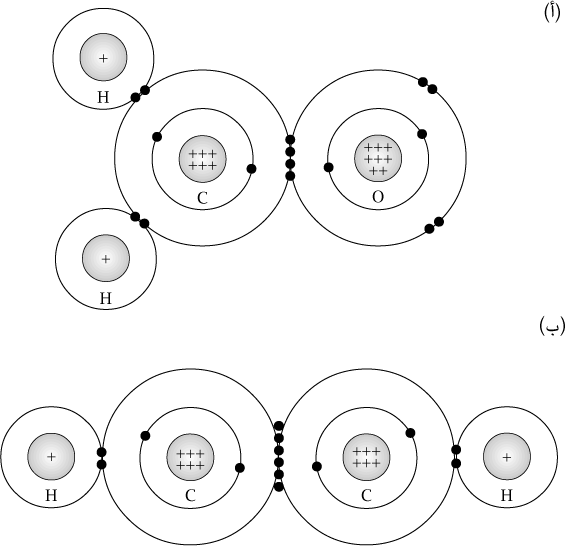
يُعَدُّ الميثان أحد أبسط الجزيئات العضوية، حيث
تشارك ذرة الكربون إلكترونات تكافئها الأربعة مع
أربع ذراتٍ من الهيدروجين. وبالمثل، تشارك كل ذرة
من ذرات الهيدروجين إلكترون تكافئها الوحيد مع ذرة
الكربون. تتكوَّن كل رابطة من إلكترونَين؛ كل ذرة
تسهم بإلكترونٍ واحد في الرابطة. ومن خلال مشاركة
إلكترونات التكافؤ، تحقق كل ذرة في الجزيء السعة
الكاملة لغلافها الخارجي (شكل
٢-٢). وعلى عكس الأيون، لا يحمل الجزيء أي
شحنة.
يمكن أن تتكوَّن رابطة تساهمية أيضًا بين ذرتَي
كربون. على سبيل المثال، يحتوي جزيء الإيثان على
رابطةٍ تساهمية بين ذرتَي الكربون فيه، وكذلك ست
روابط تساهمية بين ذرات الكربون والهيدروجين (شكل
٢-٣).
تُعَدُّ قدرة الكربون على تكوين روابط تساهمية مع
ذرات كربون أخرى أحد الأسباب الرئيسية لوجود هذا
العدد الهائل من الجزيئات العضوية. يمكن أن ترتبط
ذرات الكربون معًا بعددٍ لا حصر له تقريبًا من
الطرُق لتكوين مجموعة متنوعة ومذهلة من الهياكل
الكربونية. تشمل هذه الطرق السلاسل الخطِّية
والسلاسل المُتفرعة والحلقات، وتراكيب تجمع هذه
الحالات الثلاث معًا. ولكن لا يتوقف التنوع عند هذا
الحد. فالكربون يمكنه تكوين روابط تساهمية مع عددٍ
كبير من العناصر الأخرى. ذكرنا من قبل أن الكربون
يمكنه تكوين روابط مع الهيدروجين، إلا أنه يمكنه
أيضًا تكوين روابط مع ذراتٍ مثل النيتروجين
والفوسفور والأكسجين والكبريت والفلورين والكلور
والبرومين واليود. ونتيجة لذلك، يمكن أن تتضمن
الجزيئات العضوية تشكيلة متنوعة من العناصر
المختلفة. ونظرًا إلى قدرة الكربون على تكوين روابط
ثنائية أو ثلاثية مع ذراتٍ أخرى مختلفة، فإن المجال
يتَّسع لمزيدٍ من التنوع. لعل أكثر أنواع الروابط
الثنائية شيوعًا تلك التي تتكوَّن بين الكربون
والأكسجين، أو الكربون والنيتروجين، أو بين ذرتَين
من الكربون. ومثالُ ذلك الميثانال (الفورمالديهايد)
(شكل
٢-٤). أما عن أشهر الروابط
الثلاثية، فنجدها بين الكربون والنيتروجين، أو بين
ذرتَين من الكربون. ومثالُ ذلك الإيثاين
(الأسيتلين) (شكل
٢-٤).
تسمية المركبات وتحديد بِنيتها
أُعطِي كلُّ مركب عضوي اسمًا محددًا يعبر بدقةٍ
عن بِنيته تبعًا لقواعد التسمية التي وضعها الاتحاد
الدولي للكيمياء البحتة والتطبيقية. وكلما ازداد
تعقيد بِنية المركَّب، ازداد تعقيد الاسم. على سبيل
المثال، تسمية الاتحاد الدولي للكيمياء البحتة
والتطبيقية لأحد الهرمونات الستيرويدية المعروفة هو
(8R,9S,13S,14S,17S)-13-methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopent]a[phenanthrene-3,17-diola.
من الصعب نطق هذا الاسم بلا شك، ومن ثَمَّ
فالمركبات الشهيرة التي لها أسماء معقدة تُعطى
أسماءً أبسط تيسيرًا على المستخدِمين. على سبيل
المثال، هذا الهرمون السترويدي الذي تحدَّد له اسم
طويل على هذا النحو، تشيع معرفته باسم الإستراديول.
كما أن الكثير من المركبات ذات الأهمية البيولوجية
تُعرَف عمومًا بأسمائها الشائعة؛ ومثالًا على ذلك
المورفين والهيموجلوبين والأدرينالين.
يُولي علماءُ الكيمياء العضوية اهتمامًا خاصًّا
بالتركيب الجزيئي. فمثلما يهتمُّ المهندس المعماري
بهيكل المبنى ويستخدِم المُخططات من أجل وضع تصوُّر
له، يهتم عالِم الكيمياء بالتركيب الجزيئي أو
البنية الجزيئية، وكيفية ارتباط الذرات المكوِّنة
للجزيء معًا. ولهذا السبب، يعني التمثيل الهيكلي
للجزيء بالنسبة إلى الكيميائي ما هو أكثر من اسمِه
بكثير. رأينا سابقًا طريقة لرسم المُخططات الهيكلية
في الأشكال من
٢-١ إلى
٢-٤، ولكن تستغرق مُخططات كهذه
وقتًا طويلًا في رسمها. ويوجد أسلوب أبسط في الرسم،
حيث تُمثَّل كل رابطة بخطٍّ مُستقيم، وكل ذرة
بالرمز الكيميائي للعنصر. على سبيل المثال، التمثيل
الهيكلي للميثان والإيثان والإستراديول معروض في
شكل
٢-٥.
تحدد هذه المُخططات المبسطة جميع الذرات الموجودة
في الجزيء وطريقة ارتباطها معًا. ولكن تظلُّ هذه
الطريقة صعبة الاستخدام عند محاولة تمثيل جزيئاتٍ
معقدة مثل الإستراديول. توجد طريقة «مختصرة» أبسط
كثيرًا، وهي إزالة تسميات ذرات الكربون، وإزالة
ذرات الهيدروجين وروابطها. لا تصلح هذه الطريقة
لتمثيل الميثان، فلن يتبقَّى في التمثيل الهيكلي له
إلا نقطة، ولكن يمكن استخدامها في تمثيل الإيثان
والإستراديول (شكل
٢-٦). من
المُتعارَف عليه في هذه المركبات وجود ذرة كربون
عند طرف كل خطٍّ مستقيم، وكذلك في كل ركن.
الاستثناء الوحيد لهذه القاعدة يكون عند الإشارة
إلى رمز عنصرٍ ما، مثل مجموعتَي الهيدروكسيد
(
OH) في
الإستراديول. يمكن حساب عدد ذرات الهيدروجين
المرتبطة بكل ذرة كربون بالاستناد إلى حقيقة أن
لكلِّ ذرة كربون أربع روابط. وفي حال قلَّ العدد عن
أربع روابط، يُفترَض تلقائيًّا أن الروابط المفقودة
مُتصلة بذرات هيدروجين. يتَّضح ذلك من مقارنة بِنية
كلٍّ من الإيثان والإستراديول في الشكلَين
٢-٥ و
٢-٦.
توجد مزايا عديدة تتعلَّق بتمثيل الجزيئات بهذه
الطريقة. أولًا، أن رسمَها لا يستغرق وقتًا طويلًا.
ثانيًا، سيكون من الأسهل تحديد الهيكل الجزيئي. على
سبيل المثال، من الصعب رؤية هيكل الأشجار في الصيف
بسبب أوراقها، ولكن من السهل رؤيته في الشتاء عندما
تسقط عنها الأوراق. وفيما يتعلَّق بالجزيئات، تُشبه
ذرات الهيدروجين أوراق الأشجار. أما عن الميزة
الثالثة لرسم الجزيئات بهذه الطريقة، فهي سهولة
تحديد المجموعات الوظيفية (سنُناقشها في جزءٍ لاحق
من هذا الفصل).
الكيمياء الفراغية
الجزيئات أجسام ثلاثية الأبعاد ذات أشكالٍ معينة.
ويمكن وصف ذرات الكربون في أي جزيءٍ بأنها رباعية
السطوح، أو ثلاثية السطوح، أو ثنائية السطوح، ولكن
هذا قد يكون مُضللًا إلى حدٍّ ما؛ لأن هذه ليست
أشكال ذرات الكربون نفسها. تُشير هذه الأشكال إلى
النسق الذي تتَّخذه الروابط حول ذرات الكربون. على
سبيل المثال، يحتوي جزيء الميثان على ذرة كربون
مركزية تشير روابطها الأربع إلى أركان شكلٍ رباعي
السطوح (شكل
٢-٧). عند رسم جزيء
الميثان، تُشير الخطوط البسيطة إلى اتجاه الروابط
الموجودة في مستوى الورقة. تمثل الروابط ذات الشكل
الوتدي المُصمَت الروابط التي تتَّجه إلى خارج
الورقة في اتجاه الناظِر. وتُمثل الروابط ذات الشكل
الوتدي المُتقطِّع الروابط التي تتَّجه إلى خلفية
الورقة في عكس اتجاه الناظِر. بوجهٍ عام، تُوصَف
ذرات الكربون التي تخرج منها أربع روابط أحادية
بأنها رباعية السطوح ويكون قياس الزاوية في هذه
الروابط حوالي ١٠٩ درجات.
عندما تكون ذرة كربون جزءًا من رابطةٍ ثنائية،
فإنها تُوصَف بأنها ثلاثية السطوح وتكون الروابط
المُحيطة بها في المستوى نفسه. على سبيل المثال،
ذرَّتا الكربون في جزيء الإيثين الثلاثية السطوح،
ما يجعل الشكل الكلي للجزيء مستويًا (شكل
٢-٨). وتكون زوايا الروابط أكبر
من زوايا روابط الكربون الرباعي السطوح ويبلُغ
قياسها ١٢٠ درجة. تُوصَف ذرات الكربون المُتضمَّنة
في رابطة ثلاثية بأنها ثنائية السطوح. في هذه
الحالة، يكون قياس الزاوية بين الروابط ١٨٠ درجة،
ومن ثَمَّ يكون شكل الإيثاين (المعروف أيضًا باسم
الأسيتلين) خطيًّا.
تتسم الرابطة الثنائية في الإيثين بأنها قوية ولا
يمكن تدويرها. ولهذا الأمر نتائجه المهمة في
الكيمياء الفراغية في حال وجود مجموعاتٍ بديلة عند
كلٍّ من طرفَي الرابطة الثنائية. على سبيل المثال،
يوجَد تركيبان مختلفان مُحتمَلان لمركب ٢-بوتين
(شكل
٢-٩). يُسمَّى هذان
التركيبان الأيزومر المقرون والأيزومر المفروق. في
الأيزومر المقرون تقع مجموعات الميثيل البديلة على
الجانب نفسه من الرابطة الثنائية، بينما في
الأيزومر المفروق تقع مجموعات الميثيل البديلة
والرابطة الثنائية على جانبَين متقابلَين. لا يمكن
لِكلا الأيزومرَين أن يحلَّ أحدهما محلَّ الآخر،
وذلك بسبب الرابطة الثنائية القوية ولأنهما
مركَّبان مختلفان لهما خصائص كيميائية وفيزيائية
مختلفة.
يمكن الحصول على جزيئاتٍ عضوية ترتبط فيها ذرات
الكربون معًا لتكوين حلقات. ويمكن أيضًا أن تكون
لهذه الحلقات أشكال مُميزة. على سبيل المثال، كلٌّ
من البنزين والهكسان الحلقي عبارة عن حلقة مكوَّنة
من ستِّ ذرات (شكل
٢-١٠).
يتكوَّن الهيكل الكربوني للهكسان الحلقي من ستِّ
روابط أحادية، بينما يتكوَّن الهيكل الكربوني
للبنزين من روابط أحادية وثنائية بالتبادل. في شكل
٢-١٠، قد تبدو الحلقتان
مُتماثلتان في الشكل، ولكن عند النظر إليهما من
«منظور جانبي»، كما في شكل
٢-١٠، يتَّضح أن حلقة البنزين مستوية، بينما حلقة
الهكسان الحلقي مُجعَّدة فيما يُعرف اصطلاحًا بشكل
الكرسي. وهذه إحدى النتائج المُترتبة على اختلاف
قياسات الزوايا بين الروابط في ذرات الكربون
المُتضمَّنة في الحلقتَين. يبلغ قياس الزاوية في
روابط ذرات الكربون في الهكسان الحلقي ١٠٩ درجات
كما في حالة الميثان والإيثان. أما في البنزين،
فالزاوية بين الراوبط يبلُغ قياسها ١٢٠ درجة كما في
حالة الإيثين.
سيتضح أكثر اختلافُ الشكل بين الجزيئَين عند
إظهار ذرات الهيدروجين (شكل
٢-١١). في البنزين، تقع ذرات الهيدروجين على المستوى
نفسه مع الحلقة، بينما في الهكسان الحلقي تُشير
كلٍّ من ذرات الهيدروجين والحلقة في اتجاهَين
مختلفَين. يعني هذا أن جزيء الهكسان الحلقي أضخم
بكثير.
أطوال الروابط بين ذرات الكربون وبعضها في حلقة
الهكسان الحلقي تكون مُتماثلة، وهو أمر متوقع لأن
جميعها روابط أحادية بين ذرة كربون وأخرى. ولكن من
الغريب أن أطوال الروابط بين ذرات الكربون في حلقة
البنزين تكون متماثلة أيضًا. وهذا الأمر على خلاف
المتوقع عندما تكون الحلقة مكوَّنة من روابط أحادية
وثنائية بالتبادل، فمن المعروف أن الروابط الثنائية
تكون أقصر من الروابط الأحادية. وهذا دليل على أن
حلقة البنزين تحتوي في تركيبها على ما هو أكثر مما
يمكن أن ندركه بالعين. في واقع الأمر، تتشارك جميع
ذرات الحلقة في ستة من الإلكترونات المساهمة في هذه
الروابط الثنائية، وهي عملية تُسمَّى «عدم التموضع»
أو «عدم التمركز». تُضفي هذه العملية على حلقة
البنزين قدرًا أكبر من الاستقرار مقارنةً بجزيءٍ
يحتوي على ثلاث روابط ثنائية منفصلة. يُمثَّل عدم
تمركز إلكترونات البنزين في بعض الأحيان من خلال
رسم دائرة في منتصف حلقة البنزين لإظهار أن
الإلكترونات الستة تتحرَّك حول الحلقة (شكل
٢-١٢).
يعني استقرار حلقة البنزين أنها موجودة في كثيرٍ
من المنتجات الطبيعية، وأينما وُجدت، فإن هذا يعني
وجود منطقة مستوية في الجزيء. على سبيل المثال،
يعرض شكل
٢-١٣ صورة توضيحية
لتركيب ثلاثي الأبعاد لهرمون الإستراديول من
منظورَين مختلفَين. يبدو جليًّا أن منطقة الجزيء
المحتوية على حلقة البنزين مستوية، في حين أن بقية
الجزيء أكبر حجمًا وأكثر تعقيدًا بكثير. تلعب
المنطقة المستوية دورًا مهمًّا في النشاط البيولوجي
لهرمون الإستراديول. يحتاج الإستراديول إلى
الارتباط ببروتين مُعين في الجسم كي يؤدي نشاطه
الهرموني. ويتحقَّق هذا لسببٍ واحد، وهو أن حلقة
البنزين يمكنها الدخول في فتحة البروتين الضيقة،
وهو ما يستحيل تحقيقه مع حلقة أكبر حجمًا وأكثر
تعقيدًا.
عادةً ما تُستخدَم الروابط الوتدية الشكل للتعبير
عن الشكل الثلاثي الأبعاد للجزيء (الأشكال
٢-٧،
٢-٨،
٢-١٠،
٢-١١). كما أنها مهمة في تحديد
الاتجاه النسبي للروابط الذي قد يبدو مبهمًا إلى
حدٍّ ما. على سبيل المثال، عادةً ما يكون تمثيل
تركيب الإستراديول على النحو المعروض في شكل
٢-١٤. تحدد الروابط ذات الشكل
الوتدي النسق (أو الكيمياء الفراغية) عند مواضع
رئيسية تُسمى المراكز الكيرالية.
مركز الكربون الكيرالي عبارة عن ذرة كربون رباعية
السطوح تخرُج منها أربع روابط أحادية إلى أربع
مجموعات بديلة مختلفة. على سبيل المثال، يحتوي حمض
ألانين الأميني على مركز كيرالي يُشار إليه برمز
النجمة في شكل
٢-١٥.
يُوصَف أي جزيءٍ يحتوي على مركز كيرالي بأنه
جزيءٌ كيرالي أو عديم التناظر. بعبارة أخرى، يكون
غير انطباقي أو غير متماثِل. ثمة تركيبان محتمَلان
لهذه الجزيئات، كلٌّ منهما صورة معكوسة لا يمكن
مطابقتها مع الأخرى. فالجزيء عديم التناظُر لا
يَكون إلا إحدى الصورتَين المعكوستَين دون الأخرى،
ولا يمكن أن يكون كِلتا الصورتَين معًا. ولا يمكن
أن يتحول من تركيب إحدى الصورتَين إلى تركيب الصورة
الأخرى. تُسمَّى هذه التراكيب «الأيزومرات الضوئية»
(أو «المصاوغات المرآتية»)، والروابط الوتدية الشكل
ضرورية من أجل التمييز بين كلٍّ من هذه الأيزومرات.
من منظور علم الكيمياء، أي أيزومرين ضوئيين
يتصرَّفان بصورةٍ متطابقة تمامًا فيما يتعلق
بتفاعلاتهما مع الكواشف الكيميائية الشائعة. كما
أنهما يتماثلان في خصائصهما الفيزيائية.
قد يُوحي
ذلك للوهلة الأولى بأن خاصية الكيرالية ضعيفة
التأثير. ولكن، في واقع الأمر، للكيرالية أهمية
كبيرة. يتصرَّف الأيزومران الضوئيان للجزيء
الكيرالي بصورة متباينة عند تفاعلهما مع جزيئاتٍ
كيرالية أخرى، ولهذه الخاصية نتائج مُهمة في كيمياء
الحياة. وتقريبًا للفكرة، تأمَّل يدَيك اليسرى
واليمنى. إنهما غير متماثلتَين في الشكل وليستا
صورتَين مرآتيَّتَين يمكن مطابقتهما. وبالمثل، فإن
القفازَين غير مُتماثلَين في الشكل وليسا صورتَين
مرآتِيَّتَين يمكن مطابقتهما. ستدخل اليد اليسرى في
قفاز اليد اليسرى بسهولة، ولكن لن يحدُث المِثل لو
حاولنا إدخال اليد اليسرى في قفاز اليد اليمنى. في
العالَم الجزيئي، يحدث أمر مشابه. البروتينات في
أجسامنا جزيئات كيرالية يمكنها التمييز بين
الأيزومرات الضوئية للجزيئات الأخرى. على سبيل
المثال، تملك الإنزيمات القدرة على التمييز بين
أيزومرين ضوئيين لمركَّب كيرالي، وعلى تحفيز تفاعُل
مع أحد الأيزومرَين الضوئيين دون الآخر.
المجموعات الوظيفية
يتمثَّل أحد المفاهيم الرئيسية في الكيمياء
العضوية في المجموعات الوظيفية. والمجموعة الوظيفية
عبارة عن نَسق مُعين من الذرات والروابط. توجَد
مئات الأنواع المختلفة من المجموعات الوظيفية،
ونعرض بعضًا من أكثر المجموعات الوظيفية شيوعًا في
شكل
٢-١٦.
تتفاعل المجموعات الوظيفية بطرُق معينة، ومن
ثَمَّ يمكن توقُّع طريقة تفاعل الجزيء بناءً على
المجموعات الوظيفية الداخلة في تركيبه. على سبيل
المثال، يدخل الهيدروجين الحامضي في تركيب كلٍّ من
حمض الكربوكسيل والفينول، والذي يمكن أن يفقده
الجزيء في حال وجود قاعدةٍ قوية لتكوين أيون سالب
الشحنة (شكل
٢-١٧، وشكل
٢-١٧). إن المجموعات الوظيفية
الأمينية قلوية بطبيعتها، ويمكن إضافة بروتونات
إليها لإنتاج أيونات موجبة الشحنة (شكل
٢-١٧).
لهذه الخصائص فائدة كبيرة في الكيمياء العضوية
العملية؛ لأنه يمكن فصل المركبات التي تحتوي في
تركيبها على حمض الكربوكسيل أو الفينول أو الأمينات
عن أنواع أخرى من المركبات العضوية في عملية
تُسمَّى «الاستخلاص» (انظر أيضًا شكل
٣-١٤). تذوب المركبات المحتوية
على حمض الكربوكسيل أو الفينول في المحاليل
القاعدية، بينما تذوب المركبات المحتوية على
الأمينات في المحاليل الحامضية. المركبات العضوية
التي لا تحتوي على أيٍّ من هذه المجموعات الوظيفية
لا تذوب في الماء.
استنادًا إلى هذه الخصائص، يمكن استخلاص المركبات
التي تحتوي على حمض الكربوكسيل والفينول والأمينات
من المخاليط المُخلَّقة أو من المستخلصات
النباتية.
الروابط الجزيئية وبين الجزيئية
تتَّسم الروابط التساهمية التي تربط الذرات
«داخل» الجزيء بأنها قوية ولا يمكن كسرها بسهولة.
ولكن قد «توجد» أنواع من الروابط الأضعف بين
الجزيئات. تُسمَّى هذه الروابط بالروابط بين
الجزيئية. تتمثَّل الأنواع الرئيسية لهذه الروابط
في الترابُط الهيدروجيني، وقوى تشتُّت لندن
(المعروفة أيضًا بتفاعلات فان دير فالس)،
والتفاعلات الأيونية. تلعب التفاعلات الأيونية
دورًا مهمًّا في كيمياء الحياة وفي خصائص المركبات
الطبيعية والمُخلَّقة صناعيًّا على حدٍّ سواء. على
سبيل المثال، من المُفترض حسب الكتلة الجزيئية
المُنخفضة للماء أن يصبح الماء غازًا في درجة حرارة
الغرفة. ولكنه يظلُّ سائلًا بسبب الروابط
الهيدروجينية الموجودة بين جزيئات الماء المُفردة.
تعمل هذه الروابط بمثابة «غراء» بين الجزيئات، ومن
ثَمَّ تصبح درجة الغليان أعلى من المتوقَّع بسبب
الحاجة إلى طاقةٍ أكبر لكسر الروابط الهيدروجينية
بين الجزيئية (شكل
٢-١٨).
وبالمثل، فإن درجة غليان أحماض الكربوكسيل أعلى من
المتوقَّع بسبب الروابط الهيدروجينية.
ما هي الروابط الهيدروجينية وكيف تتكوَّن؟ تعتمد
الروابط الهيدروجينية على وجود ذراتٍ ذات شحنةٍ
جزئية داخل الجزيء. على سبيل المثال، تحمل ذرة
الأكسجين في جزيء الماء شحنة جزئية سالبة يُشار
إليها بالرمز
δ− في
شكل
٢-١٨، بينما تحمِل ذرَّتا
الهيدروجين شحنةً جزئية موجبة
(
δ+). تَنتُج
هذه الشحنة الجزئية عن اختلاف قِيَم السالبية
الكهربية بين ذرتَي الهيدروجين وذرة الأكسجين
المُكوِّنة لجزيء الماء. يقع عنصر الأكسجين في يمين
الجدول الدوري، مما يعني أنه يحمل سالبية كهربية
أكبر مقارنةً بالهيدروجين. نتيجة لذلك، تُمارس ذرة
الأكسجين قوة جذب أكبر على الإلكترونات داخل كل
رابطةٍ هيدروجينية. وبما أن إلكترونات الرابطة
ينتهي بها المطاف في موقع أقرب إلى ذرة الأكسجين،
تزداد سالبية ذرة الأكسجين نوعًا ما وتزداد إيجابية
ذرة الهيدروجين نوعًا ما. وهكذا، فإن الروابط
الهيدروجينية المكوِّنة لجزيء الماء تكون تساهمية
قطبية بطبيعتها، وليست تساهمية فحسب.
نظرًا إلى هذه الشحنات الجزئية، يمكن لجزيئاتٍ
مختلفة من الماء أن تتفاعل معًا بحيث يمكن لذرة
أكسجين ذات شحنةٍ جزئية في جزيءٍ ما أن تتفاعل مع
ذرة هيدروجين ذات شحنة جزئية في جزيء آخر. يشار إلى
هذه التفاعلات في شكل
٢-١٨
بخطوطٍ متقطعة. وبما أن التفاعل يحدث بين شحنة
سالبة نوعًا ما وأخرى موجبة نوعًا ما، يمكن اعتباره
نمطًا ضعيفًا من التفاعلات الأيونية. ومع ذلك،
يُسمى هذا التفاعل بالترابط الهيدروجيني لأنه
يتضمَّن ذرة هيدروجين ذات شحنة موجبة نوعًا ما.
تُعرف ذرة الهيدروجين المشاركة في الرابطة
الهيدروجينية بمانِح الرابطة الهيدروجينية، في حين
تُعرف ذرة الأكسجين ذات الشحنة السالبة نوعًا ما
بمستقبِل الرابطة الهيدروجينية.
يمكن أن يحدث الترابط الهيدروجيني بين الجزيئات
عندما يحتوي جزيء على ذرة كهروسلبية ذات شحنة جزئية
سالبة (مستقبِل الرابطة الهيدروجينية)، ويحتوي
الجزيء الآخر على ذرة هيدروجين ذات شحنة جزئية
موجبة (مانِح الرابطة الهيدروجينية). عادةً ما يكون
مستقبِل الرابطة الهيدروجينية ذرة أكسجين أو
نيتروجين، بينما يكون مانِح الرابطة الهيدروجينية
ذرة هيدروجين مرتبطة بذرة أكسجين أو نيتروجين. يلعب
الترابط الهيدروجيني دورًا مهمًّا في عملية
التعرُّف الجزيئي، مثل قدرة الإنزيمات على التعرُّف
على الركائز (الفصل الرابع)، أو قدرة دواءٍ أو
مبيدٍ حشري مُعين على الارتباط ببروتين مُستهدَف
(الفصلان الخامس والسادس).
يمكن أن تحدُث التفاعلات الأيونية بين الجزيئية
في حال كان جزيءٌ من اثنَين يحتوي على مجموعةٍ
وظيفية موجبة الشحنة، وكان الجزيء الآخر يحتوي على
مجموعةٍ وظيفية سالبة الشحنة. ويمكن أن يحدث ذلك
إذا كان أحد جزيئَين يحتوي على مجموعة أمينيوم،
ويحتوي الجزيء الآخر على مجموعة كربوكسيل (شكل
٢-١٩). والتفاعل الأيوني
أقوى بكثيرٍ من الرابطة الهيدروجينية.
تحدث قوى تشتُّت لندن (أو تفاعلات فان دير فالس)
عادةً بين مناطق هيدروكربونية من جزيئات مختلفة، أو
بعبارة أخرى مناطق تحتوي على ذرات الكربون
والهيدروجين فقط. ويكون هذا التفاعل أضعفَ بكثيرٍ
من الرابطة الهيدروجينية أو الرابطة الأيونية، ولكن
ينبغي عدم التقليل من قيمته. وغالبًا ما تحدُث
تفاعلات فان دير فالس بين الجزيئات بوتيرةٍ أكبر من
الترابط الهيدروجيني أو التفاعلات الأيونية، ومِن
ثَمَّ يمكن أن يكون التأثير الإجمالي لهذه
التفاعُلات كبيرًا للغاية. ومن المُحتمَل أن يحدث
هذا التفاعل بسبب الحركة العشوائية للإلكترونات بين
الذرات والجزيئات. ويُمكن أن يترتَّب على ذلك وجود
مناطق غنية بالإلكترونات أو خالية من الإلكترونات
بصورةٍ مؤقتة. ويكون هذا التأثير مؤقتًا وعابرًا
لأي منطقةٍ مُحددة. ولكن، يمكن أن يترتب على هذه
المناطق الانتقالية ذات الكثافة الإلكترونية
المتبايِنة حدوث تفاعل جاذب بين الجزيئات؛ حيث
تتفاعل منطقة انتقالية غنية بالإلكترونات في جزيءٍ
ما مع منطقة انتقالية خالية من الإلكترونات في
جزيءٍ آخر.
يمكن أيضًا حدوث الترابط الهيدروجيني والتفاعُلات
الأيونية وقوى التشتُّت بين مناطق مختلفة من الجزيء
نفسه. عندما يحدث ذلك، تُوصَف التفاعُلات بأنها
«داخل» الجزيئات وليست «بينها». تلعب هذه التفاعلات
دورًا مهمًّا في الطريقة التي تُطوى بها الجزيئات
الكبيرة (الجزيئات الضخمة)، مثل البروتينات
والأحماض النووية، على هيئة أشكال بعينِها.