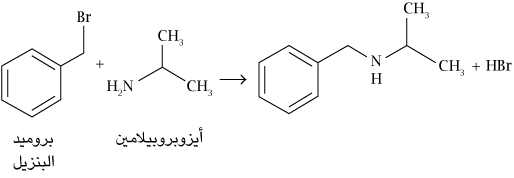
تخليق المُركبات العضوية وتحليلها
يعتمِد التصميم الحديث للعقاقير أو المبيدات الحشرية أو العطور أو مكسبات الطعم أو البوليمرات بصفةٍ أساسية على علماء الكيمياء الحيوية. ويرجع ذلك إلى كونهم خبراء في استكشاف العالَم الجزيئي، وإلى تدرُّبهم على فَهم تركيب الجزيئات العضوية وخصائصها وتفاعلاتها. علاوةً على ذلك، يمتلك علماء الكيمياء العضوية المهارات العملية اللازمة لتخليق بُنًى وتراكيب جديدة، الأمر الذي يجعل الأبحاث التي تُجرى داخل معامل التخليق العضوي صعبةً وملهمة في الوقت نفسه. لم تكن أبحاث التخليق الصناعي أبدًا عملًا روتينيًّا، وكلُّ يومٍ يمكن أن يُمثل رحلةً استكشافية جديدة. كما أنه ليس بالمجال القابل للتوقُّع؛ إذ يمكن لتفاعُلٍ معيَّن أن يعطيَ ناتجًا مختلفًا عن الناتج المتوقَّع أو المُخطَّط له. وقد يكون ذلك مثارًا للإحباط أحيانًا، ولكنه يُقدم أيضًا فرصًا جديدة للبحث والاستكشاف إذا اتضح أن هذا الناتج غير المُتوقَّع له خصائص مفيدة.
تتَّسم الأبحاث في مجال الكيمياء العضوية بأنها إبداعية وعَملية في آنٍ واحد. والإبداع مطلوب من أجل تصميم جزيئاتٍ جديدة من المتوقَّع أن تتَّسم بخصائص مفيدة. كما أنه مطلوب عند وضع مسارٍ لتخليق مُركَّب مُعين، وهو أمر أشبه بشطرنج كيميائي. ولتحقيق هذَين الهدفَين، لا بد أن يكون لدى الباحث فهم نظري عميق للكيمياء العضوية، وكذلك قدرة على تطبيق هذه المعرفة بطريقة مُبتكَرة على كلِّ ما يطرأ من مشكلاتٍ جديدة. ولكن، يحتاج الباحثون الكيميائيون أيضًا إلى مهاراتٍ عملية دقيقة إذا كانوا بصدد تنفيذ إجراءاتٍ تخليقية في المعمل. يجب أن تتوفر لدى عالِم الكيمياء «أنامل خضراء» تُضاهي أنامل البستاني. وفيما يبدو، يتمتع بعض علماء الكيمياء العضوية بلمسةٍ سحرية، ولديهم القدرة على تنفيذ التفاعُلات بأسلوبٍ أنجح من غيرهم. كما يجب أن تتوفر لدى عالِم الكيمياء العضوية مهاراتٌ تحليلية جيدة ليتمكَّن من إثبات أن الناتج المُتحقق في التفاعل هو الناتج المطلوب. وإذا كان الناتج خلاف ذلك، فإن الباحث الكيميائي يتقمَّص شخصيةَ المُحقِّق لتحديد هُويَّة المركَّب الناتج والتوصُّل إلى آلية تكوُّنه.
الإعداد لعملية التخليق


إنها عملية تخليق من خطوتَين تتضمَّن ثلاثة جزيئاتٍ أساسية. تتمثَّل الخطوة الأولى في تفاعُل ١-نافثول مع جزيء يحتوي على مجموعتَين وظيفيتَين هما الإيبوكسيد وكلوريد الألكيل. في الظروف القاعدية، تتفاعل مجموعة الفينول في مركب ١-نافثول مع كلوريد الألكيل وتطرد الكلور. يربط هذا التفاعل الجزيئَين معًا عبر رابطة جديدة بين الأكسجين والكربون لتكوين ناتج يحتوي على إيثر وإيبوكسيد. لاحظ أن الفينول يتفاعل مع كلوريد الألكيل ولا يتفاعل مع الإيبوكسيد. يُعَدُّ هذا مثالًا على الانتقائية الكيميائية، التي يُظهر فيها تفاعل ما ميلًا إلى انتقاء مجموعة وظيفية (هاليد الألكيل) دون غيرها (الإيبوكسيد).



توجد عدة أسباب أخرى لتنفيذ تحوُّلات المجموعات الوظيفية، لا سيَّما عند تخليق جزيئات معقدة. على سبيل المثال، قد تفتقر المادة الأولية أو وسيط التخليق إلى وجود مجموعةٍ وظيفية في موضع رئيسي من التركيب الجزيئي. ومن ثَمَّ، قد يستلزم الأمر حدوث العديد من التفاعلات من أجل الحصول على هذه المجموعة الوظيفية.
في حالاتٍ أخرى، قد تُضاف المجموعة الوظيفية إلى موضعٍ معيَّن ثم تُزال في مرحلة لاحقة. ويرجع أحد أسباب إضافة هذه المجموعة الوظيفية إلى منع حدوث تفاعل غير مرغوب فيه عند هذا الموضع من الجزيء.

ثمة حالة شائعة أخرى تُحوَّل فيها مجموعة وظيفية تفاعلية إلى مجموعة وظيفية أقل تفاعلًا حتى لا تتداخل مع تفاعُل لاحق. وفيما بعد، تُعاد المجموعة الوظيفية الأصلية إلى حالتها الأولى عن طريق تفاعُلٍ آخر من تحولات المجموعات الوظيفية. وتُعرف هذه العملية باسم استراتيجية الحماية/إزالة الحماية.

يتطلب الأمر قدرًا كبيرًا من المهارات والإبداع عند تصميم عمليات تخليق متعددة المراحل للجزيئات المعقدة وتنفيذها بنجاح، ويجب أن تكون لدى علماء الكيمياء القائمين على هذه العمليات معرفةٌ دقيقة بالتفاعلات المحتمَلة لمختلف المجموعات الوظيفية. ولذلك، حصل عدد من علماء الكيمياء العضوية على جائزة نوبل في الكيمياء نظير جهودهم في الإعداد لتخليق منتجاتٍ طبيعية معقدة من مواد أولية بسيطة. على سبيل المثال، فاز السير روبرت روبنسون، وهو عالِم كيمياء عضوية بريطاني، بجائزة نوبل عام ١٩٤٧ نظير تخليقه العديد من أشباه القلويات، بينما كُرِّم عالِم الكيمياء الأمريكي روبرت وودوارد عام ١٩٦٥ نظير تخليقه منتجاتٍ طبيعيةً معقدة مثل الكينين والكوليسترول والإستركنين والكلوروفيل. كما فاز إلياس جيمس كوري، وهو عالِم كيمياء أمريكي شهير، بجائزة نوبل عام ١٩٩٠ نظير تخليقه جزيئاتٍ معقدة وابتكاره أساليبَ تخليق جديدة.
أحد أكبر التحديات الحالية التي تواجه علماء الكيمياء هو تخليق المايتوتوكسين، وهو سُم عصبي متعدِّد الحلقات ذو كتلة جزيئية ضخمة، يُنتِجه نوع من العوالق البحرية في المحيط الهادئ. ويُعزى الكثير من حالات التسمُّم الغذائي إلى تناول أسماك تغذَّت على هذه العوالق. لا تُعَدُّ عملية تخليق هذا الجزيء المُعقَّد بكل مراحلها مشروعًا مُجديًا من الناحية الاقتصادية، إلا أن تخليقَ أجزاءٍ أبسط من الجزيء يمكن أن يؤدي إلى اكتشاف عقاقير جديدة يمكن استخدامها في علاج أمراض الانتكاس العصبي. قد يبدو هذا التصوُّر غريبًا. إذا كان المايتوتوكسين سامًّا، فقد تكون الأجزاء الأبسط في تركيبه سامَّة أيضًا. ولكن لا تنفي سُمِّية المركب احتمالية استخدامه طبيًّا ودوائيًّا. وتوجَد بالفعل أمثلة كثيرة على سموم أثبتت فاعليتها كعقاقير. على سبيل المثال، سُم التوبوكورارين المُستخدَم في السهام، الذي كانت قبائل أمريكا الجنوبية تستخدِمه قديمًا في صيد الطرائد، أصبح يُستخدَم الآن كحاصِر عصبي عضلي في العمليات الجراحية. والواقع أنه طبقًا لمبادئ الطب الأساسية، فإن جرعة العقار هي التي تُحدِّد إن كان تأثيره سيكون سامًّا أم علاجيًّا. يُعَدُّ المورفين، الذي استُخدِم كمُسكِّن خلال الحرب الأهلية الأمريكية، من أقدم الأمثلة على ذلك. إذا استُخدِم المورفين بجرعته الصحيحة، فسيكون فعالًا، ولكن إذا زيدت الجرعة عشرة أضعاف، فقد ثبت أن تأثيره يكون مُميتًا.
التخليق العكسي
يوجد الكثير من الإرشادات التي من شأنها مساعدة الكيميائي في تحديد الروابط المناسبة التي يمكن كسرها، ولكن ثمة مبدأ رئيسي وهو أن الجزيئات المحددة من كسر الروابط يجب أن تكون حقيقية. كما أنه لا بد من وجود تفاعل معروف يسمح لهذه الجزيئات بالارتباط معًا في عملية تخليق حقيقية لتكوين هذه الرابطة نفسها. ولهذا السبب، تشمل الروابط التي من المفضَّل كسرها رابطة الكربون والأكسجين، ورابطة الكربون والنيتروجين؛ لأن هذه الروابط يمكن إنشاؤها بأعداد كبيرة باستخدام تفاعلاتٍ معروفة جيدًا.

إذا كان الجزيئان المُحددان من كسر رابطة ما متوفرين تجاريًّا، فيمكن حينئذٍ شراء هذَين الجزيئَين وإجراء التفاعل. وإذا لم يكن الجزيئان متوفرَين تجاريًّا، يُجرى تحليل آخر لعملية التخليق العكسي حتى تتحدَّد المواد الأولية المتوفرة. وإذا كانت البِنى المستهدَفة معقدة، فسيتضمن مخطط التخليق العكسي العديد من الخطوات، بما يعادل عدد الخطوات المطلوبة خلال عملية التخليق نفسها.
إجراء تفاعل ومراقبته
يُعَدُّ إجراء التفاعلات عملية بسيطة للغاية في جوهرها. يُمزج المركب (أ) مع المركب (ب)، ويكون ذلك عادةً باستخدام مُذيب يذوب فيه كلا المركبَين. ويُعَدُّ الماء مذيبًا مثاليًّا؛ نظرًا إلى ما يوفره من حيث انخفاض التكلفة، وارتفاع مستوى الأمان، والتأثير الضئيل على البيئة. ولكن، للأسف، أغلب المُركبات العضوية لا تذوب في الماء، ومن ثَمَّ يكون استخدام المذيبات العضوية أكثر شيوعًا. تشمل المذيبات الشائعة الاستخدام الإيثانول، وثنائي كلورو الميثان، ورباعي الهيدروفوران، وخلات الإيثيل (أسيتات الإيثيل)، والبروبانون (الأسيتون)، والتولوين، وثنائي ميثيل السلفوكسيد، وثنائي ميثيل الفورماميد. لكلٍّ من هذه المُذيبات مميزاته وعيوبه، ويكون اختيار المُذيب الأنسب لتفاعلٍ مُعين بناءً على التجارب السابقة الناجحة.
من المهم مراقبة سير التفاعل بعد مزج مكوناته المختلفة معًا. إن الصورة الشائعة عن التفاعلات الكيميائية هي التغيرات اللونية الفورية، وكمية الفوران والأبخرة الكثيرة، والانفجارات في بعض الأحيان. ولكن الواقع أن عددًا ضئيلًا جدًّا من التفاعلات هو الذي تنتج عنه تأثيراتٌ بصرية وسمعية لافتة يمكن رؤيتها في التجارب الكيميائية. في الغالب الأعم، تتضمَّن التفاعلات مزجَ محلولَين عديمَي اللون لإنتاج محلول آخر عديم اللون. وتكون التغيرات التي تحدُث في درجة الحرارة ذات دلالة كبيرة. إذا تولَّدت حرارة عن التفاعل (تفاعل طارد للحرارة)، فهذا يعني أن محلول التفاعل يزيد درجة الحرارة. ولكن لا تُولِّد جميع التفاعلات حرارة، كما أن مراقبة درجة الحرارة ليست أسلوبًا موثوقًا لمعرفة إذا ما كان التفاعل قد اكتملَ أم لا. ثمة أسلوب أفضل لمعرفة ذلك، وهو أخذ عيناتٍ صغيرة من محلول التفاعُل في أوقاتٍ مختلفة واختبارها باستخدام أسلوب الاستشراب أو التحليل الطيفي.

يرتفع المذيب إلى أعلى اللوح بفِعل الخاصية الشعرية ويسحب المُركَبَين معه. يختلف المدى الذي تصل إليه المركبات أعلى اللوح من مركَب لآخر حسب قطبية المركب نفسه. فكلما زادت قطبية المركب، قصرت المسافة التي يتحرَّكها على اللوح. يرجع ذلك إلى أن السيليكا مادة قطبية، وهو ما يعني أن المُركبات القطبية «تلتصق» بها بقوة أكبر من المُركبات غير القطبية. بمجرد اقتراب المذيب من قمة اللوح، يُزال اللوح من خزان الاستشراب ويترك المذيب ليتبخَّر. يمكن رؤية البُقع على لوح استشراب الطبقة الرقيقة بسهولة إذا كانت المركبات المتضمَّنة ذات لون بطبيعتها. ولكن، للأسف، أغلب المركبات عديمة اللون، ومن ثَمَّ يُلون اللوح من أجل الكشف عن أماكن البقع. ثمة طريقة أخرى وهي معالجة لوح استشراب الطبقة الرقيقة بأبخرة اليود. يتفاعل اليود مع أي مركباتٍ موجودة ويُظهرها على هيئة بقع بُنيَّة اللون.



تغيير ظروف التفاعل
إذا كان التفاعل يحدث ببطءٍ شديد، فيمكن تجربة ظروف تفاعل مختلفة لتسريعه. قد يتضمَّن ذلك رفع درجة حرارة التفاعل، أو إجراء التفاعل تحت ضغط، أو تقليب محتويات التفاعل بقوة، أو التأكد من إجراء التفاعل في جوٍّ جاف، أو استخدام مُذيب مختلف، أو استخدام عامل حفَّاز، أو استخدام أحد الكواشف بوفرة.
من جانب آخر، قد يكون التفاعل نشطًا للغاية وقد ينتُج عنه ظهور شوائب ونواتج ثانوية غير مرغوب فيها. في بعض التفاعلات، قد يتكوَّن الناتج المطلوب ولكنه ينحلُّ أو يدخل في تفاعلاتٍ أخرى. ومرةً أخرى، قد يتحسَّن الوضع بتغيير ظروف التفاعل. على سبيل المثال، يُمكن أن يُجرى التفاعل في درجة حرارة أقل، أو في وجود النيتروجين.
هناك عدد كبير من المُتغيرات التي يمكنها التأثير في كفاءة حدوث التفاعل، وعادةً ما يتمثل دور علماء الكيمياء العضوية في مجال الصناعة في تهيئة الظروف المِثالية لتفاعُلٍ بعينه. ويُسمى هذا المجال في الكيمياء العضوية ﺑ «التطوير الكيميائي».
عزل ناتج التفاعل وتنقيته
بمجرد أن يحدُث التفاعل، يصبح من الضروري عزل ناتج التفاعل وتنقيته. غالبًا ما تستغرق هذه العملية وقتًا أطول يفوق الوقت المستغرَق في إجراء التفاعل نفسه. الطريقة النموذجية لفعل ذلك هي إزالة المذيب المُستخدَم في التفاعل بحيث لا يبقى سوى ناتج التفاعل. ولكن قد لا يكون ذلك ممكنًا في أغلب التفاعلات، فمِن المحتمَل وجود مركبات أخرى في خليط التفاعل. على سبيل المثال، قد لا يكون التفاعل قد قطع المسار كاملًا حتى اكتماله، ومن ثَمَّ ستظلُّ كميات ضئيلة من مواد التفاعل الأولية والكواشف موجودة. يحدُث ذلك تحديدًا عندما تُضاف كمية أكبر من إحدى المواد الأولية بغرَض الحصول على كمية جيدة من الناتج. ويمكن أيضًا أن تتكوَّن أملاح غير عضوية بناءً على نوع الكواشف المُستخدَمة. وفي نهاية التفاعل، قد تظهر شوائب ناتجة عن تفاعلاتٍ ثانوية، حيث تشارك المواد الأولية في تفاعُلٍ آخر بخلاف التفاعل الأصلي. ولهذا السبب، من الضروري عادةً فصل ناتج التفاعل المطلوب وعزله عن هذه المركبات الأخرى. تُعرف هذه العملية باسم تنقية التفاعل أو معالجته.
تبدأ تنقية التفاعل عادةً بمجموعةٍ متنوعة من عمليات الاستخلاص. إذا أُجري التفاعل في مذيب عضوي لا يمتزج بالماء، يمكن إجراء عملية الاستخلاص على الفور. من أمثلة هذه المُذيبات ثنائي كلورو الميثان، وأسيتات الإيثيل، وثنائي إيثيل الإيثر. أما إذا أُجري التفاعل في مذيب «يمتزج» بالماء، فيجب إزالة المذيب عن طريق عملية التبخر. وبعدها، يُذاب ناتج التفاعل الخام في مذيبٍ عضوي مناسب لا يمتزج بالماء.

وبذلك، تحتوي طبقة المركب العضوي حاليًّا على الشائب (ب) وناتج التفاعل (د). ويعني عدم اختزال الشائب إلى محلولٍ قاعدي أو حمضي أنه لا يحتوي على مجموعةٍ وظيفية حامضية أو قاعدية.
المرحلة التالية هي تجفيف طبقة المُركب العضوي لإزالة أيِّ آثار للماء. يتم ذلك بإضافة ملح لامائي، مثل كبريتات المغنيسيوم، الذي يمتص الماء دون أن يؤدي إلى انحلال المذيب العضوي. يمكن إزالة الملح عن طريق الترشيح، ثم إزالة المذيب العضوي عن طريق التقطير لإعطاء الناتج الخام (د)، متضمِّنًا الشائب (ب).
من الضروري عند هذه المرحلة تنقية الناتج الخام لإزالة الشائب (ب). وإحدى الطرق الممكنة لذلك إجراء عملية البلورة. تتضمَّن هذه العملية إذابة الناتج الخام في مُذيبٍ يمكن أن يذوب فيه الناتج (د) ولكن بمقدارٍ محدود. وهذا يعني ضرورة التسخين من أجل إذابة الناتج. وبعدها يُترك المحلول الساخن حتى يبرد. وفي تلك الأثناء، يتبلور الناتج (د) منفصلًا عن المحلول. وعلى افتراض أن الشائب موجود ولكن بكمياتٍ ضئيلة للغاية، فإن إمكانية تبلوُره تكون أقل ومن ثَمَّ يظلُّ موجودًا في المحلول. وعندئذٍ، يمكن ترشيح بلورات الناتج النقي من المحلول.
التحليل البنيوي
بافتراض إتمام التفاعل بنجاح وفَصْل الناتج وتنقيته، يصبح من الضروري تحديد تركيب هذا الناتج. لا يمكن التنبؤ بنتيجة أي تفاعل يقينًا، وتظل دائمًا احتمالية أن يعطي التفاعل ناتجًا آخر بخلاف الناتج المقصود قائمة. التخليق العضوي ليس مشروعًا للهندسة المدنية حيث تُربَط عوارض معًا بطريقة متوقَّعة. تتفاعل الجزيئات بطرُق مفاجئة وغير متوقَّعة.
في الظروف المثالية، سيكون من الجيد أن نتمكَّن من فحص الجزيء عبر المجهر وإلقاء نظرة مباشرة عليه. ولكن هذا ليس مُمكنًا للأسف. إن أقرب طريقة تُمكِّن المرء من تخيُّل البنية المباشرة لجزيءٍ ما تكون من خلال الحصول على بلورة للناتج وإخضاعها لتقنية تُسمى تصوير البلورات بالأشعة السينية. يمكن لهذه الطريقة تحديد الذرات الموجودة في الجزيء وتقديم تمثيل مرئي لكيفية ارتباط هذه الذرات معًا، وهذا أقرب ما يمكن أن يحصل عليه المرء للتصوير الجزيئي. ولكن يستغرق تصوير البلورات بالأشعة السينية وقتًا طويلًا. علاوة على ذلك، فإن جزءًا كبيرًا من المركبات العضوية المخلَّقة في المعمل عبارة عن زيوتٍ وموائع، أو لا يمكن أن تُعطينا بلورات نُخضِعها للدراسة. ومن هنا، ظهرت الحاجة إلى ابتكار طرق أخرى غير مباشرة لتحديد بِنية هذه المركبات وتركيبها.

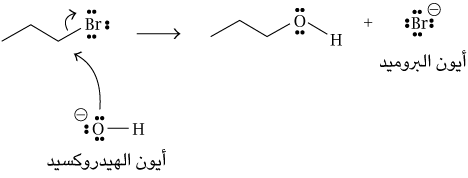
آليات التفاعل
ثمة جانب مُهم في الكيمياء العضوية، وهو فهم كيفية أو آلية حدوث التفاعلات. تتضمن التفاعلات تكوين روابط تساهمية وكسر روابط تساهمية أخرى. ومن خلال آلية التفاعُل، تتحدَّد الإلكترونات المشاركة فيه. بعبارة أخرى، في حال تكوين رابطة جديدة، يتحدَّد من أين يأتي إلكترونا هذه الرابطة. وفي حال كسر رابطة ما، يتحدَّد إلى أين يذهب إلكترونا هذه الرابطة.

يشير السهم المموج في الجزء السفلي من الشكل إلى أن زوج الإلكترونات الوحيد على ذرة الأكسجين في أيون الهيدروكسيد قد استُخدِما لتكوين رابطة جديدة بين الأكسجين والكربون. ونتيجة لذلك، أصبحت ذرة الأكسجين الموجودة في الناتج لديها حاليًّا زوجان وحيدان من الإلكترونات بدلًا من ثلاثة. كما أنها تفقد شحنتها السالبة.
هذه الآلية بسيطة نسبيًّا، ولكنها توضح المبدأ الذي استخدمنا على أساسه الأسهم المموجة. يجب أن يبدأ السهم المموج عند زوج من الإلكترونات، وهو ما يعني أن السهم يبدأ عند زوج إلكتروناتٍ وحيد في ذرةٍ ما، أو عند رابطة تساهمية بين ذرتَين. ويتَّجه السهم بعد ذلك إلى حيث يصل الإلكترونان في نهاية المطاف. وهذا بدَوره قد يكون رابطة تساهمية جديدة بين ذرتَين أو زوجًا وحيدًا جديدًا من الإلكترونات في ذرةٍ ما.